شیمی عمومی باتری
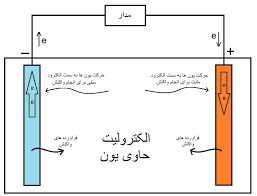
شیمی عمومی باتری یک باتری دارای سه لایهی کاتد، آند و جداکننده است. لایه منفی باتری، آند و لایه مثبت آن، کاتد نامیده میشود. هنگامی که یک بار الکتریکی به باتری اضافه شود، جریان از آند به کاتد شارش مییابد. به طور مشابه، هنگامی که شارژر باتری را وصل کنیم، جریان در جهت مخالف یعنی از کاتد به آند شروع به شارش میکند.
هر باتری بر اساس یک واکنش شیمیایی، یعنی واکنش اکسایش-کاهش کار میکند. این واکنش بین کاتد و آند و از طریق جداکننده (الکترولیت) رخ میدهد. در نتیجه، یک الکترود به علت واکنش اکسایش به صورت منفی باردار میشود. این الکترود، کاتد نام دارد. الکترود دیگر به علت واکنش کاهش به صورت مثبت باردار میشود که آن را آند مینامند. هنگامی که دو نوع فلز مختلف در محلول الکترولیت یکسانی فرو برده شوند، یکی از الکترودها الکترون میگیرد و دیگری الکترون از دست میدهد.
در نتیجه، یکی از فلزها الکترون میگیرد و دیگری الکترون از دست خواهد داد. این اختلاف در تراکم الکترون دو فلز، بین فلزها اختلاف پتانسیل الکتریکی ایجاد میکند. این اختلاف پتانسیل میتواند به عنوان منبع ولتاژ در هر وسیله الکتریکی استفاده شود. یونها فقط از طریق جداکننده جریان مییابند و جداکننده تمام حرکات از آند به کاتد را مسدود میکند. بنابراین، تنها راه دریافت جریان خارجی، از طریق پایانههای باتری است.
شکل زیر چند نماد مربوط به باتریها را نشان میدهد.